88858cc永利官网戴志飞">戴志飞课题组在癌症纳米诊疗制剂研究中取得重要进展,相关工作发表在材料领域著名期刊Adv. Mater., Adv. Funct Mater.和Biomaterials上。
癌症光热治疗通过运用近红外光吸收剂和对人体组织穿透力较强的近红外光使肿瘤组织温度升高,选择性地杀死肿瘤细胞,是一种绿色治疗方法。治疗前需准确确定肿瘤位置,治疗过程需实时监控,治疗后需评价疗效,这些工作均可通过医学成像完成。目前癌症纳米诊疗制剂大多为无机材料,且诊断(成像)和治疗分别由2种或2种以上的组分来完成,不仅增加了制备工艺的复杂性,且大量外来物质进入人体增加了机体的负担。
为解决这一问题,戴志飞">戴志飞课题组研制了在近红外区有很强的吸收的聚吡咯纳米粒子。它可将吸收的光能转化成热能,使肿瘤组织温度升高,有效地杀死恶性肿瘤细胞,对肿瘤进行光热治疗。论文(Adv. Mater., 2013, 25, 777-782)发表后引起广泛关注,迄今已被引用73次。与88858cc永利官网李长辉">李长辉课题组合作进一步证明聚吡咯纳米粒子能显著增强光声成像对比度,最大成像深度可达光学成像的5倍。相关论文(Nanoscale, 2013, 5, 4462-4467)已被引用35次。因此,聚吡咯纳米粒子是一种有效的诊疗制剂,可实现光声成像引导下的癌症光热治疗,从而避免对正常组织的损伤。
光声成像具有较高的灵敏度和实时成像的能力,但其成像深度较浅,仅可应用到浅表面。相反,超声成像具有较高的空间分辨力,但是灵敏度较低。将光声和超声两种成像模式融合,可实现优势互补。课题组与北医三院王金锐教授和张幼怡教授合作研制了聚吡咯纳米胶囊,不仅可实现光声/超声双模态成像,还可进行光热治疗。该工作发表在Biomaterials, 2014, 35, 287–293。由于光声/超声双模态成像系统已商品化,因此与之相应的双模态造影剂聚吡咯纳米胶囊具有重要的应用前景。
上述3篇论文的第一作者为博士生查正宝(1987年出生),2013年6月毕业前往美国从事博士后研究,2014年底被聘为合肥工业大学的正教授。
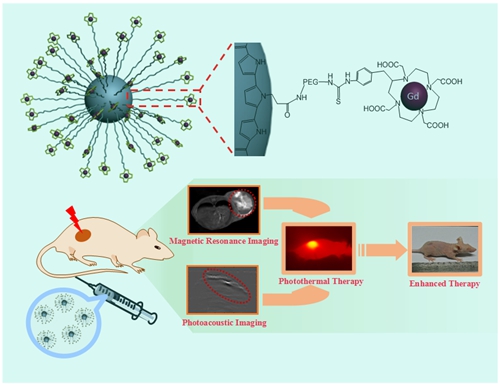
磁共振成像可提供解剖细节和高质量的软组织三维图像,但其灵敏度较低。将磁共振和光声这两种高度互补的成像融合可获得更多、更全面的信息,从而实现精准光热治疗。戴志飞">戴志飞课题组通过聚乙二醇将四氮十二环四乙酸钆连接到聚吡咯纳米粒子上,静脉注射后能选择地富集在肿瘤部位,导致光声和T1磁共振信号均显著增强,使肿瘤组织和正常组织明显地区分开来,从而引导近红外激光准确照射肿瘤部位,两周后实现了肿瘤的完全消融,并减少了对肿瘤周围正常细胞的损伤。相关结果发表在Adv. Funct. Mater. (2015, 25, 1451–1462),并被选为“亮点”推荐(http://www.materialsviewschina.com/2015/02/15412/)。博士后梁晓龙为该文的第一作者,2014年出站后被聘为中科院生物物理所的副研究员。
以上工作得到国家杰出青年科学基金和国家自然科学重点基金的资助。










